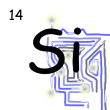
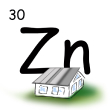
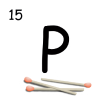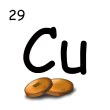Vzdelávacia oblasť: VÝZNAMNÉ CHEMICKÉ PRVKY A ZLÚČENINY
Tematický celok: NEUTRALIZAČNÉ A REDOXNÉ REAKCIE
Téma: pH INDIKÁTORY
Medovníčky sa upiekli do zlatista a rozvoniava z nich celý dom. Sú výborné, chutné i neozdobené. Ale k medovníčkom predsa patrí poleva a sú krásne vyzdobené všelijakými vzormi. Lenže stalo sa, že sme zabudli kúpiť potravinárske farbivo a zdobiť len bielou polevou sa nám nie veľmi páči. Čo teraz? Hm… a čo tak pomôcť si trošku znalosťami z chémie?
Pozri si video, ako sme naše perníčky ozdobili pekne farebne…
Pomôcky a chemikálie:
výluh z červenej kapusty, bielok z vajíčka, práškový cukor, citrónová šťava, voda, 4 mištičky, 4 lyžičky, 4 sáčky na zdobenie, perníky
Postup:
- Priprav si výluh z červenej kapusty podľa postupu v tomto odkaze.
- Z vajíčkového bielka a preosiateho práškového cukru priprav tuhý sneh.
- Bielkový sneh rozdeľ do troch mištičiek.
- Do prvej mištičky nakvapkaj približne za lyžičku citrónovej šťavy.
- K bielku s citrónovou šťavou prilej približne lyžičku výluhu z červenej kapusty a zamiešaj (ak sa poleva veľmi zriedi, pridaj trochu práškového cukru a dobre vymiešaj).
- K bielku v druhej mištičke pridaj lyžičku výluhu červenej kapusty a dobre premiešaj.
- Polevu v tretej mištičke nechaj bielu.
- V štvrtej mištičke vymiešaj polevu z práškového cukru a výluhu z červenej kapusty (bez bielka).
- Pripravenými polevami naplň vrecúška na zdobenie a môžeš začať ozdobovať perníčky.
Vysvetlenie sfarbenia polevy

Bielková poleva z vaječného bielka je bielej farby

Keď k bielkovej poleve pridáme výluh z červenej kapusty, poleva sa sfarbí do tyrkysova. Farebná zmena výluhu z červenej kapusty, ktorá je prírodným pH indikátorom, indikuje podľa pH farebnej stupnice červenej kapusty zásadité prostredie. Nuž a vaječný bielok je zásaditý.

Keď k bielkovej poleve pridáme šťavu z citróna, zmeníme pH na kyslé. Túto zmenu pH prostredia indikuje farba pridaného výluhu z červenej kapusty – poleva sa sfarbí do ružova.

Ak pripravíme polevu len z vody a cukru a pridáme výluh z červenej kapusty, farba polevy ostane fialová, pretože pH prostredie je neutrálne.
Farebná stupnica prírodného pH indikátora červenej kapusty

Naše farebne ozdobené medovníčky