Vzdelávacia oblasť: PREMENY LÁTOK
Tematický celok: SPOZNÁVANIE CHEMICKÝCH REAKCIÍ V NAŠOM OKOLÍ
Téma: HASENIE POŽIARU A HASIACE LÁTKY
Pozorne si pozri videoprezentáciu a odpovedz prosím na otázky nižšie.
Otázky:
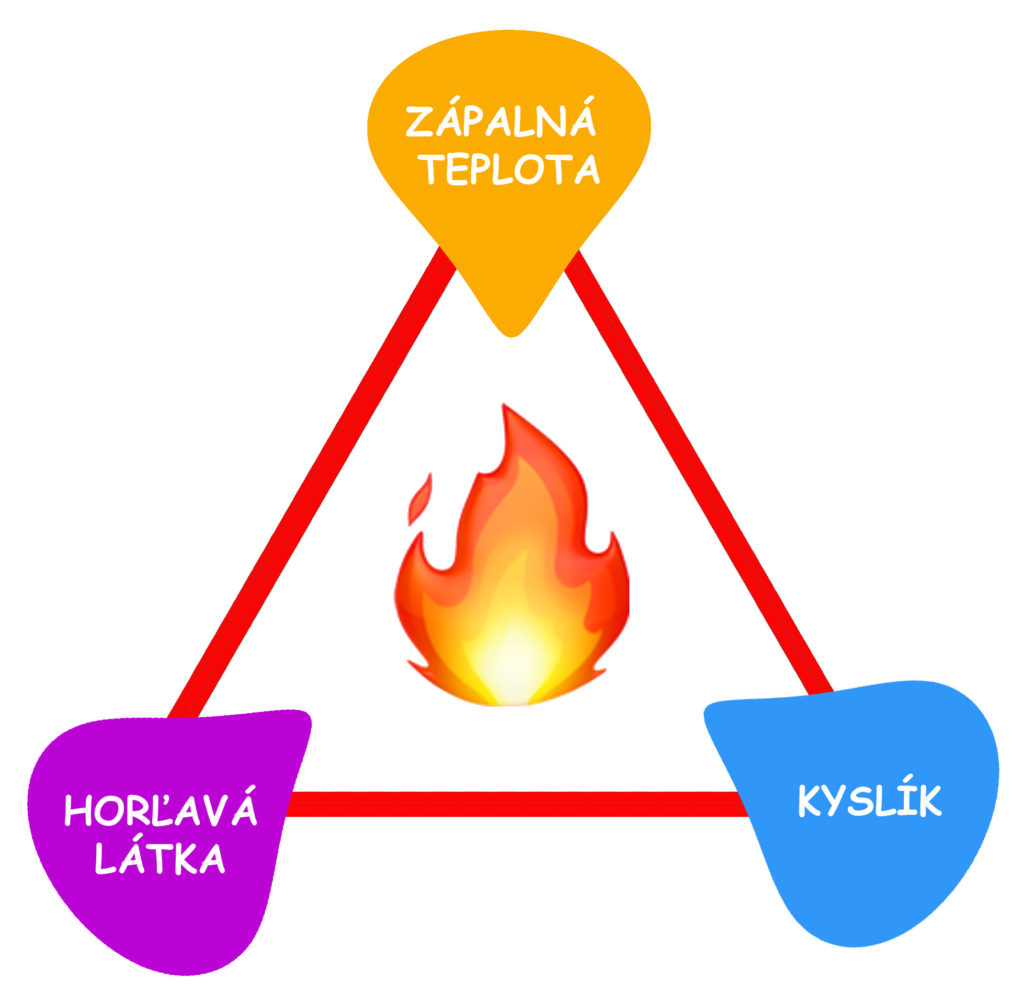
- Vymenuj podmienky horenia:
- Môže dôjsť k horeniu, ak je jedna z podmienok horenia nesplnená?
- Vysvetli svoju odpoveď v druhej otázke.
- Ako je možné spomaliť alebo zastaviť horenie?
- Uveď konkrétny príklad, ako sa dá zastaviť požiar odstránením horiacej látky a vysvetli:
- Aký je najčastejší spôsob hasenia? Ktorú podmienku horenia narúša?
- Ktorá je najbežnejšia hasiaca látka? A ktorý spôsob hasenia jej použitím využívame?
- Môžeme vodou hasiť elektrické zariadenia pod napätím? Zdôvodni svoju odpoveď.
- Snehový hasiaci prístroj obsahuje oxid uhličitý, ktorý má teplotu -78°C. Podobá sa na sneh. Ktorý spôsob hasenia využívame pri použití tohto hasiaceho prístroja?
- Prečo nemôžeme použiť penový hasiaci prístroj na hasenie elektrických zariadení pod napätím?
- Ktoré hasiace látky alebo hasiace prístroje môžeme použiť na hasenie elektrických zariadení pod napätím?
- V kuchyni nastal menší požiar. Začal horieť olej na panvici (zápalná teplota 230°C). Bolo sa treba rýchlo rozhodnúť, ako požiar uhasiť skôr, než sa chytí celá kuchyňa.
- Mama nabrala hrniec vody a rýchlo ho vyliala na panvicu. Nastal výbuch. Voda sa okamžite premenila na paru, strhla kvapôčky horúceho horiaceho oleja a tie sa rozpŕchli po celej kuchyni.
- Mama zobrala utierku, navlhčila ju a rýchlo ňou prikryla horiacu panvicu. Oheň uhasila.
Vysvetli, čo sa stalo v prvom a v druhom prípade. Prečo sa vodou olej nepodarilo uhasiť a utierkou áno? Ktorý spôsob hasenia tu bol využitý?