Meď a železo
Vzdelávacia oblasť: VÝZNAMNÉ CHEMICKÉ PRVKY A ZLÚČENINY
Tematický celok: NEUTRALIZAČNÉ A REDOXNÉ REAKCIE
Téma: REDOXNÉ DEJE
Vlož kúsok kovu Fe do roztoku CuSO4 a kúsok kovu Cu do roztoku FeSO4
Pozoruj…
Čo z pokusu vyplýva?
Fe reagovalo s CuSO4, pozoroval si vznik vrstvičky Cu na povrchu Fe klinčeka.
Cu s FeSO4 nereagovala.
Fe, ktoré sa nachádza v RRK vľavo, redukovalo/vytesnilo Cu, ktorá sa nachádza v RRK napravo z jej zlúčeniny
Cu, ktorá sa nachádza v RRK vpravo, nevytesnila Fe, ktoré sa nachádza v RRK naľavo z jeho zlúčeniny
Kovy nachádzajúce sa v RRK na ľavo sú schopné redukovať/vytesniť kovy (z ich zlúčenín) napravo od nich !!!
A preto je možné hliníkovú lyžičku postriebriť, zlato potiahnuť vrstvou platiny, železný kľúč poniklovať…
Experiment pokrytia železe vrstvičkou medi, alebo redukcie medi železom si môžeš vyskúšať aj doma.
Pomôcky
sklený pohárik menší a väčší, vrchnáčik/tanierik
Chemikálie
mince zo severského zlata (10, 20 alebo 50 centovka), železný klinček, kuchynský ocot.
Postup:
- Do skleného pohárika nalej 1 dcl kuchynského octu a vlož 2-3 mince zo severského zlata.
- Pohárik prikry, aby sa kvapalina tak rýchlo neodparovala a zmes nechaj 2 týždne reagovať na výrazne teplom mieste (radiátor, krb).
- Po dvoch týždňoch prelej 1/3 pripraveného zeleného roztoku octanu meďnatého do menšieho pohárika a vlož do neho železný klinček.
- Pozoruj.
Pozorovanie:
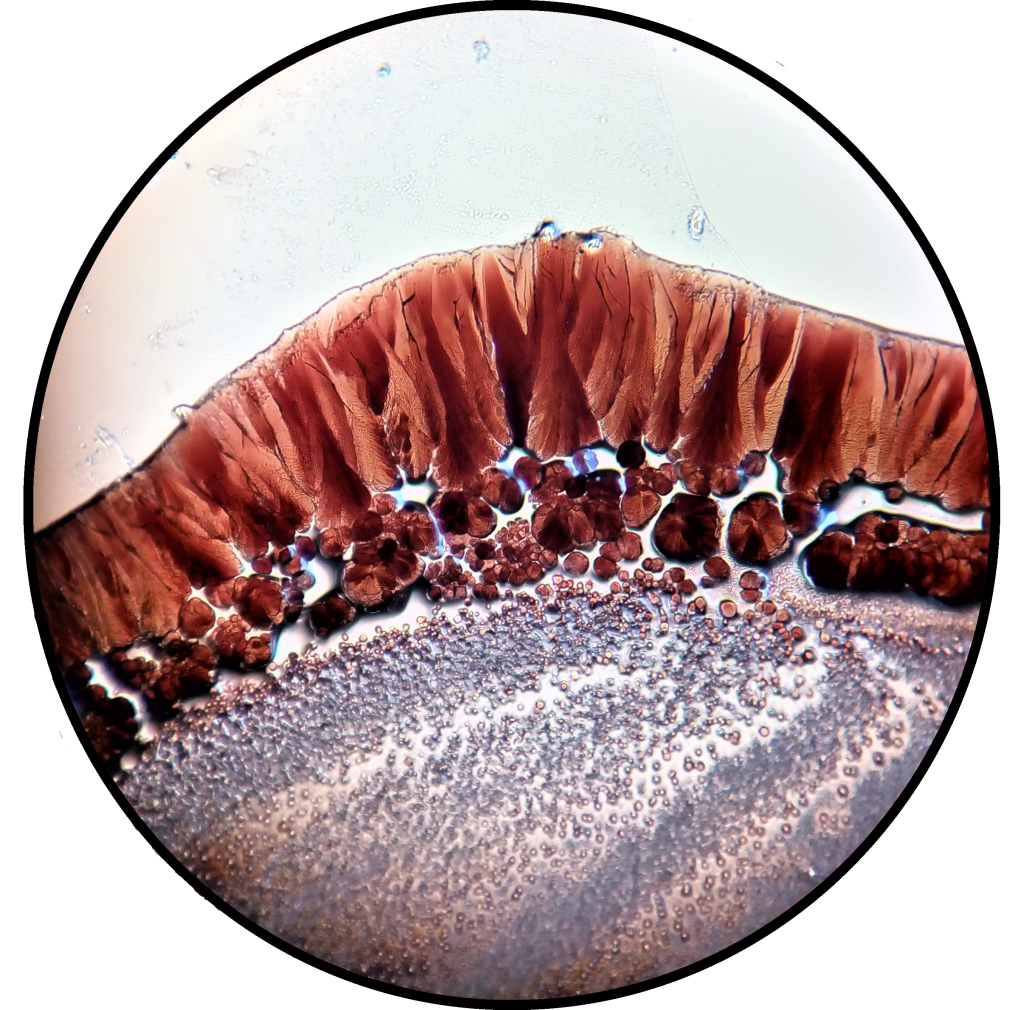
Na povrchu železného klinčeka sa po chvíľke začne tvoriť súvislá vrstva medi – klinček striebornej farby začne hnednúť. Zelená farba roztoku sa mení na žlto-hnedú, pretože vzniká octan železnatý.
Železný klinček pokrytý vrstvičkou medi v mikroskope, L. Dovalová

Kryštáliky octanu meďnatého v mikroskope, L. Dovalová
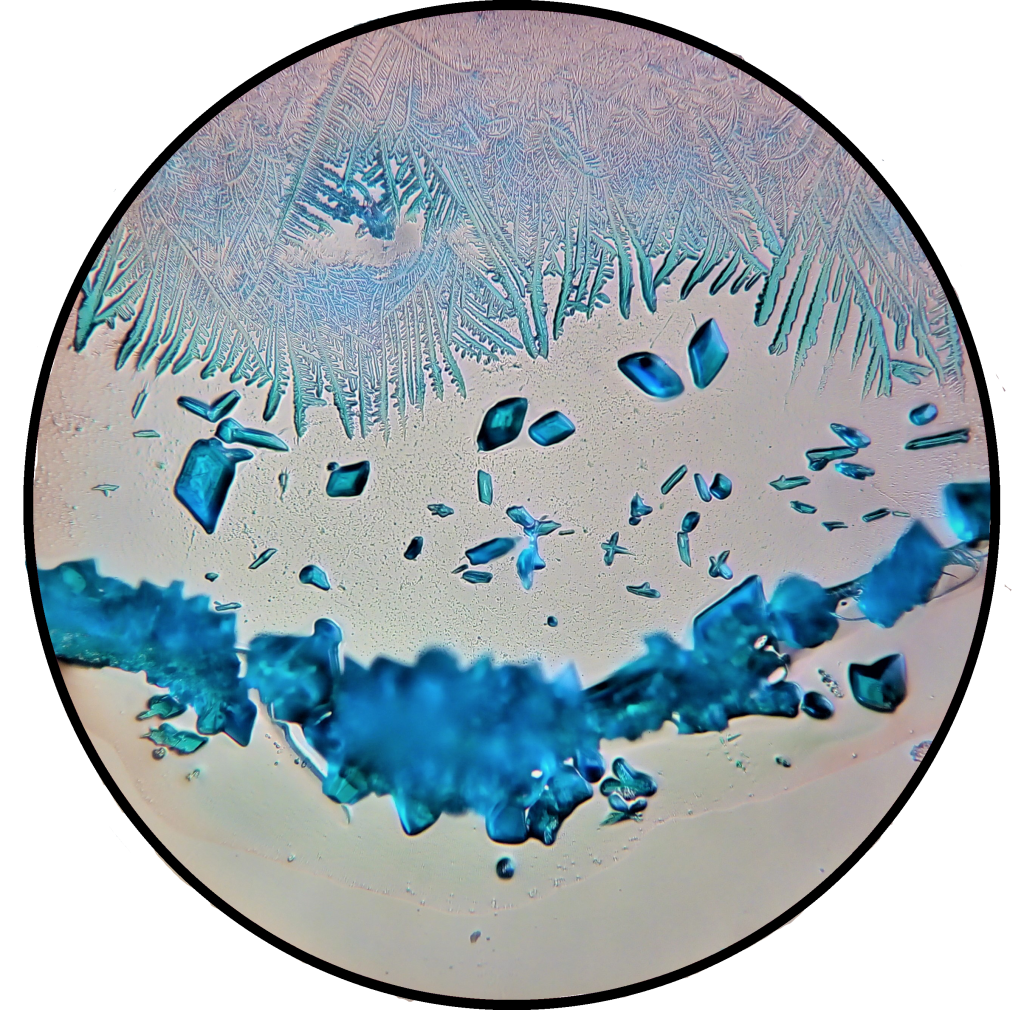
Kryštáliky octanu železnatého v mikroskope, L. Dovalová