Vzdelávacia oblasť: ORGANICKÉ LÁTKY
Tematický celok: ORGANICKÉ LÁTKY V ŽIVÝCH ORGANIZMOCH a V BEŽNOM ŽIVOTE
Téma: SACHARIDY, PLASTY
Mladému chemikovi sa podarilo izolovať škrob zo zemiaku. Premýšľal, čo by s ním mohol robiť ďalej. Zistil, že využitie škrobu v potravinárstve, farmácii aj chemickom priemysle je mnohoraké. Škrob sa používa ako zahusťovadlo, spojivo, liečivo či lepidlo… Pri hľadaní informácií našiel, že škrob má ešte jedno zaujímavé využitie. Je možné z neho vyrobiť plast.
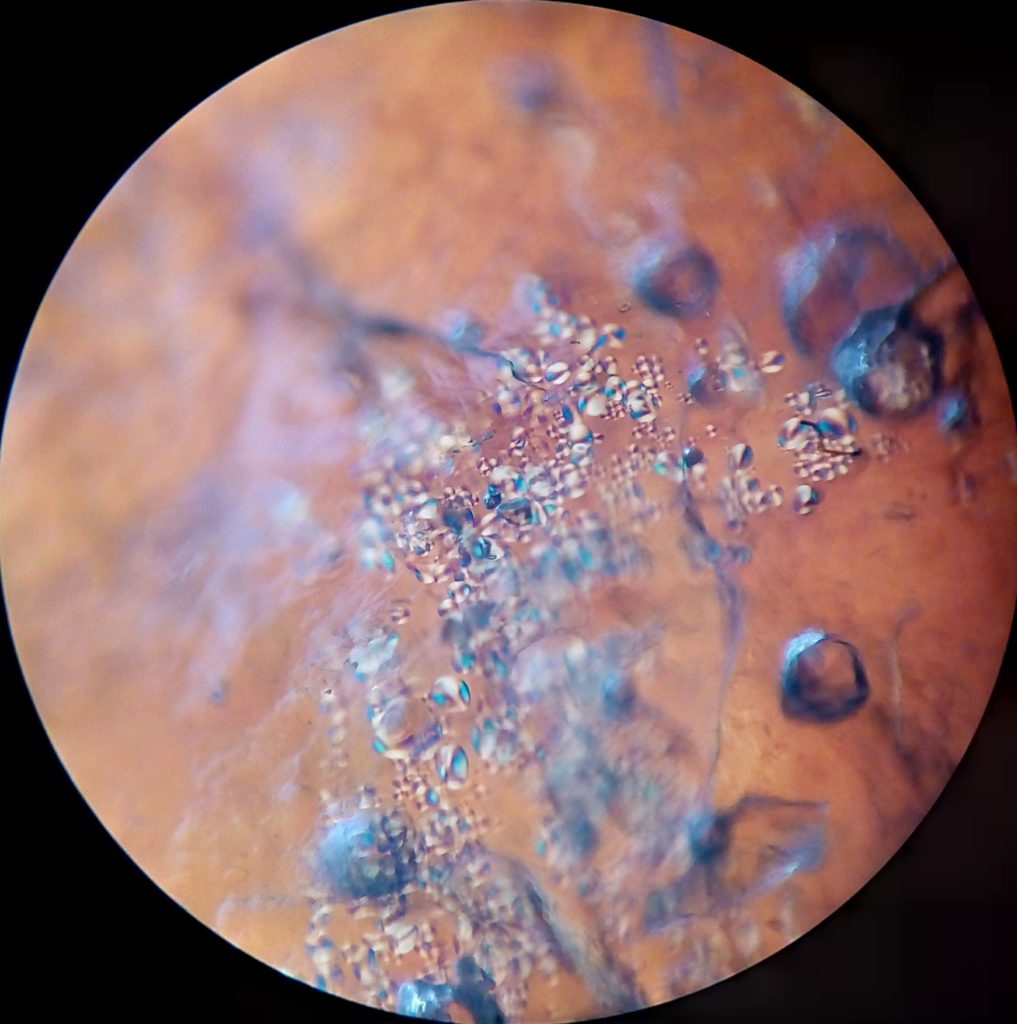
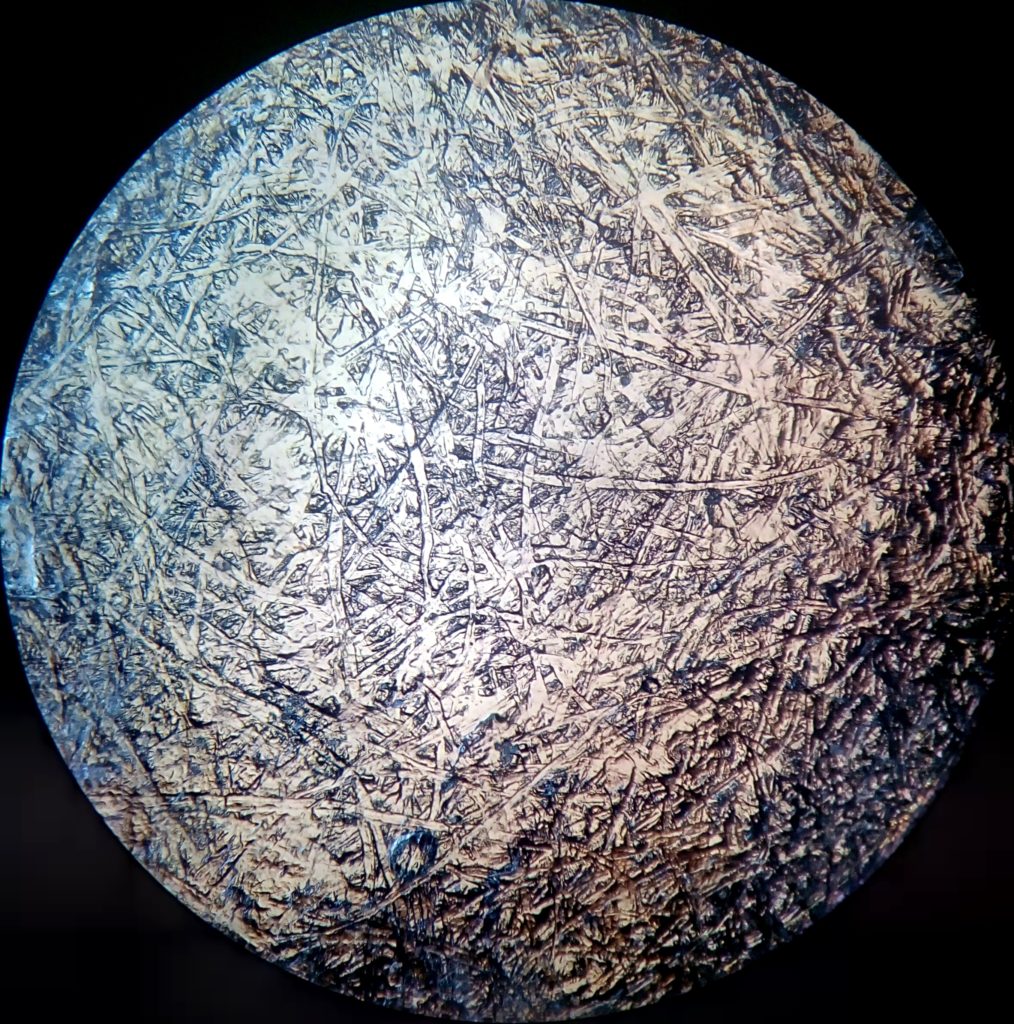
Škrob je polymér vytvorený z dlhého reťazca navzájom viazaných molekúl glukózy. V mikroskope ich môžeš pozorovať ako zrniečka či guľôčky.
Bežný plast je tiež polymér. Pripravuje sa polymerizáciou, teda spájaním menších molekúl, monomérov do dlhého reťazca dovtedy, až kým tento reťazec nenadobudne správnu dĺžku. Takto vytvorený plast sa stane elastickým a zároveň pevným. Reťazec škrobu je príliš dlhý na to, aby z neho mohol vzniknúť plast. Preto je najskôr potrebné polymér škrobu „skrátiť“ na kratšie kúsky použitím „nožníc“ v podobe kyseliny. Až tieto menšie časti reťazca môžu vytvoriť plast. Plastickosť tejto hmoty dosiahneme pridaním glycerolu, pretože glycerol je kvapalina s vysokou viskozitou.

Pomôcky:
malá panvica alebo rajnička, vareška, lyžica, papier na pečenie alebo alobal
Chemikálie:
zemiakový škrob, kuchynský ocot, voda, glycerol (z lekárne)
Postup:
Vytvoríš dva rôzne kúsky plastu.
1. plast s gylcerolom
- Do rajničky nasyp 1 lyžicu škrobu a pridaj k nemu 5 lyžíc vody a premiešaj.
- K zmesi pridaj 1 lyžicu octu a pol lyžice glycerolu. Poriadne premiešaj.
- Obsah v rajničke zohrievaj za stáleho miešania na miernom ohni, až kým sa hmota nezmení na priesvitnú a gumovú, jemne lepkavú.
- Vzniknutú hmotu rozotri na papier na pečenie do tenkej vrstvy a nechaj voľné na vzduchu stáť, až kým sa vysuší.
2. plast bez glycerolu
- Do rajničky nasyp 1 lyžicu škrobu a pridaj k nemu 5 lyžíc vody a premiešaj.
- K zmesi pridaj 1 lyžicu octu. Poriadne premiešaj.
- Obsah v rajničke zohrievaj za stáleho miešania na miernom ohni, až kým sa hmota nezmení na priesvitnú a gumovú, jemne lepkavú.
- Vzniknutú hmotu rozotri na papier na pečenie do tenkej vrstvy a nechaj voľné na vzduchu stáť, až kým sa vysuší.
Ak nemáš dostatok škrobu na odmeranie 2 lyžíc, použi menšie kávové lyžičky.
Plast si môžeš ponechať ešte k ďalšiemu experimentu podľa návodu „mladého chemika“ uvedeného nižšie v tabuľke…




Mladý chemik si položil ešte jednu otázku: „Môžem plast, ktorý som vyrobil pokladať za bioplast?“
Bioplast je ekologická náhrada tradičného plastu (vyrobeného zo surovín na báze ropy). Bioplast je vyrobený z obnoviteľných zdrojov, jeho výroba nesie menšiu uhlíkovú stopu v porovnaní s výrobou tradičných plastov, má menšiu toxicitu ako bežný plast (neobsahuje rôzne toxické prísady napr. na báze chlóru) a najmä sa rýchlejšie rozkladá. Bioplast musí spĺňať dve podmienky – biodegradovateľnosť a výrobený z obnoviteľných zdrojov.
Vlastnosti dvoch pripravených kúskov rôznych plastov môžeš medzi sebou porovnať podobne ako to spravil mladý chemik, ktorý svoje pozorovanie prehľadne zapísal do tabuľky.





POPREMÝŠĽAJ, VYHĽADAJ, ZISTI a POPÍŠ…
- Uveď, čo spoločné majú škrob a plast.
- Vysvetli, čo znamená polymerizácia, čo polymerizáciou vzniká.
- Popremýšľaj kvôli čomu sa do zemiakového škrobu pridáva ocot pri výrobe plastu.
- Prečo sa do plastu pripraveného zo škrobu pridáva glycerol? Vyber správne tvrdenie.
- aby bol krehký b) aby bol mäkký
- aby bol plastický d) aby bol tvrdý
- Uveď aký je rozdiel v postupe prípravy prvého a druhého kúska plastu?
- Na základe pozorovaných vlastností plastov (ktoré mladý chemik zapísal vyššie do tabuľky) rozhodni, ktorý z dvoch plastov by mohol byť vhodný k výrobe týchto dobre známych plastových produktov (označ S GLY alebo BEZ GLY):

- Môže mladý chemik vyrobený plast pokladať za bioplast? Vysvetli/zdôvodni svoje tvrdenie.
- Uveď rozdiely medzi bioplastom a tradičným plastom.






































