Vzdelávacia oblasť: LÁTKY A ICH VLASTNOSTI
Tematický celok: ZMESI A CHEMICKY ČISTÉ LÁTKY
Téma: CHROMATOGRAFIA
Akú farbu má list kríčka či nechtíka lekárskeho z dažďovej záhradky pred školou? A čo tráva či list púpavy z divokého kúta školskej záhrady, alebo drobné listy agátu, ktorý rastie pri plote? Otázka pre škôlkara, čo sa práve učí farby – veď predsa zelenú, zelenú… to neviete? Všetko je zelené… alebo keď prichádza jeseň, tak zase žltú … Áno, aj to je správna odpoveď a to i z fyzikálneho pohľadu – lom svetla a videnie farieb… ale pre chemika nie jednoznačná odpoveď. V rastlinách a teda aj v ich listoch sa nachádzajú rôzne pigmenty (chlorofyly, karotenoidy, fykobilíny). Pigmenty sú látky, ktoré okrem špeciálnej funkcie (ako napr. chlorofyl – potrebný k fotosyntéze), dávajú rastline aj jej špecifické sfarbenie (prevažnú časť roka zelené). Týchto pigmentov je v jednom liste niekoľko, aj keď navonok môžeš o liste určite povedať, že je zelený. Lenže tieto pigmenty nie sú len tak viditeľné. „Pozri“ sa na ne pomocou špeciálnej separačnej metódy – chromatografie (jednoduchší experiment s chromatografiou si si už mohol vyskúšať v lekcii Chromatografia). Pomocou chromatografie na TLC doštičke sa Kremíkom podarilo z listu oddeliť okolo 10 i viac rôznych pigmentov – zelené, žlté, oranžové. Kremíci skúmali niekoľko rôznych rastlín zo školskej záhrady a porovnávali pigmenty obsiahnuté v zelených listoch a v listoch zožltnutých – jesenných. Zistili, že zožltnuté a suché listy majú farbiva menej a nie tak sýteho, ako listy zelené, niektorým zožltnutým listom zelené farbivo úplne chýbalo. Chlorofyly – zelené farbivá, sa na zimu rozkladajú, chloroplasty odumierajú – učíš sa na biológii. Pomocou chromatografie si to môžeš potvrdiť. No a akú farbu má teda zelený či žltý list? Pre chemika je určite mnohofarebný 🙂 Stačí spraviť chromatogram.
TLC znamená tenkovrstvá chromatografia (Thin Layer Chromatography). Stacionárnou fázou je tenká vrstva adsorbentu (napr. oxid kremičitý), ktorá je nanesená na platničke (hliníkovej, sklenej alebo z plastu). Pomocou TLC môžeš rozdeliť zmes zlúčenín na základe ich rôznej afinity k povrchu adsorbentu a rôznej rozpustnosti v zmesi organických rozpúšťadiel (mobilná/pohyblivá fáza).
Pomôcky:
trecia miska, filtračná aparatúra, kadička, sklená tyčinka, malá banka, pipeta, elektrická platnička, nádoba na vodný kúpeľ, držiak na banku, rukavice
Chemikálie:
uhličitan vápenatý, jemný piesok, acetón, destilovaná voda, isopropanol, lekárenský benzín, listy a kvety rastlín
Postup:
- Približne 2 g listov rozotri v trecej miske s malým množstvom jemného piesku, uhličitanom vápenatým a niekoľkými ml acetónu.
- Zmes prefiltruj cez hladký papierový filter namočený v acetóne do malej banky.
- Filtračný koláč premy 10 ml acetónu.
- Filtrát odpar vo vodnom kúpeli do sucha.
- Odparok rozpusti v niekoľkých ml acetónu.
- Vzorku nanes na TLC doštičku pipetou na štartovaciu čiaru v podobe malých bodiek.
- TLC platničku so vzorkou vlož do vyvíjacej zmesi, nádobu uzavri a nechaj vyvíjať.
- Chromatogram po vyvinutí vyber a nechaj vysušiť.



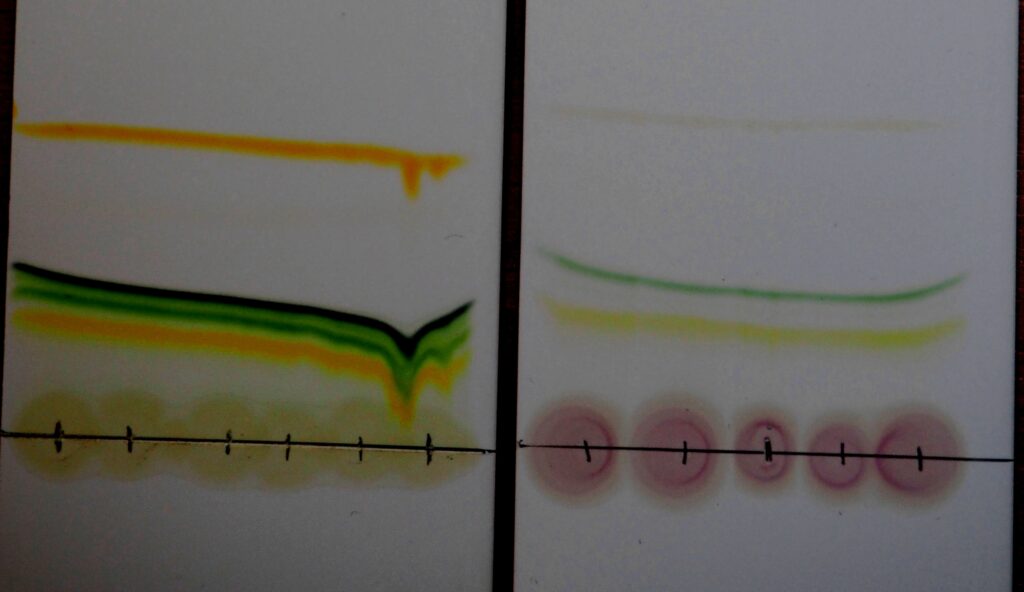
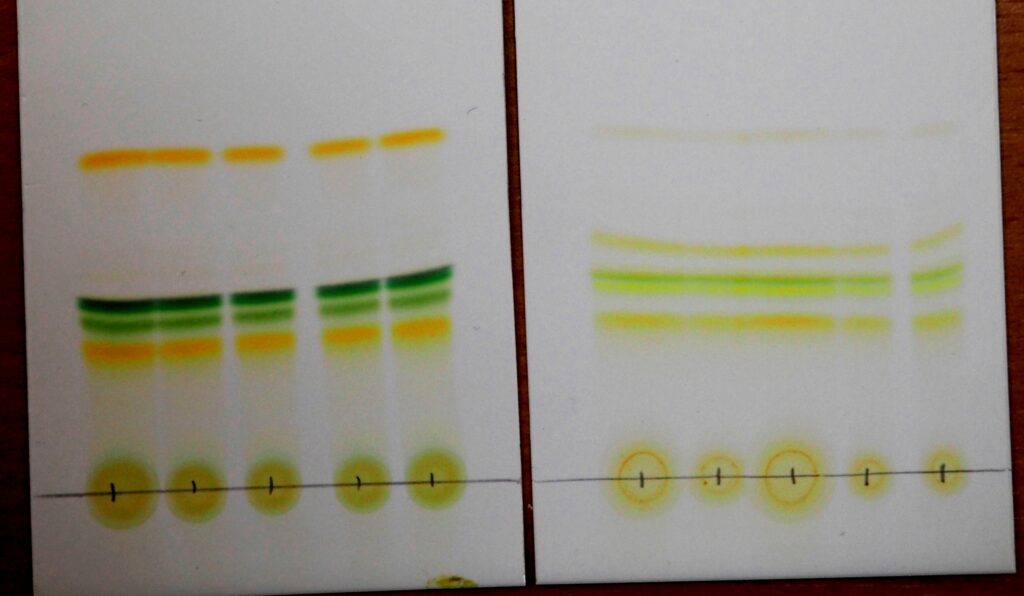





Chromatogramy pripravené žiakmi z chemického krúžku Kremík – porovnanie zelených a farebných/suchých listov rôznych rastlín
TIPY:
- 2 g listov je minimálne množstvo na vytvorenie extraktu. Môžeš pokojne spracovať aj väčšie množstvo – extrakt bude silnejší a následne chromatogram výraznejší.
- Malá banka so širším hrdlom je vhodnejšia, pretože acetón sa z nej skôr vyparí.
- Pracuješ s acetónom, veľmi prchavou a dráždivou chemickou látkou. Preto pracuj s použitím ochranných prostriedkov a v digestore.
- Ako nádobu na vyvíjanie môžeš použiť aj veľkú kadičku prípadne zavárací pohár.
POPREMÝŠĽAJ, VYHĽADAJ, ZISTI a POPÍŠ…
- Pokús sa vysvetliť, prečo chemik nemôže jednoznačne povedať, že list je zelený.
- Vysvetli, akou metódou si získal zmes farbív z listu rastliny.
- Uveď aké rozpúšťadlo si použil na extrakciu farbív z listu rastliny.
- Opíš ako, akým spôsobom zistíš, aké farbivá obsahuje zelený list.
- Uveď čo znamená TLC
- Opíš stacionárnu a pohyblivú fázu chromatografie na tenkej vrstve.
- Popremýšľaj, prečo sú listy počas roka zelené a na jeseň žltnú až hnednú.
- Vieš dokázať, že jesenné listy už skutočne neobsahujú zelený chlorofyl? Uveď akým spôsobom.
- Okrem extrakcie a chromatografie si v experimente použil ešte jednu metódu oddeľovania zložiek zmesi. Uveď ktorá to bola.
- Uveď čo sa nachádza po ukončení filtrácie na filtračnom papieri.
- Uveď ako sa nazýva kvapalina, ktorá počas filtrácie pretiekla cez filtračný materiál do zbernej nádoby (kadičky, banky).





















